领域突破:Hans Clevers和Marc van de Wetering团队开发首个体外长期培养的“舌前部类器官”模型
来源:类器官学社 2025-12-02 09:08
本研究阐明,舌前部上皮主要由基底细胞/角质形成细胞谱系相关转录因子驱动,而舌后部上皮则受细胞迁移与增殖相关因子主导,两类区域在上皮分化过程中存在明显的转录调控差异。
舌是吞咽、味觉感知及机械刺激感知的关键器官。其前部与后部具有区域特异性的发育起源,并由成体上皮干/祖细胞维持稳定。目前仍缺乏可用于研究舌前部生物学的体外模型。
2025年9月,来自荷兰玛西玛公主小儿肿瘤中心的Hans Clevers和Marc van de Wetering团队在期刊Advanced Science(IF: 14.1)上发表了一篇题为Organoid Modeling of Mouse Anterior Tongue Epithelium Reveals Regional and Cellular Identities的研究文章。本研究开发了一种从成年小鼠舌背前部建立长期扩增类器官的方案, 为舌生物学研究提供了工具。
Part.01
研究背景
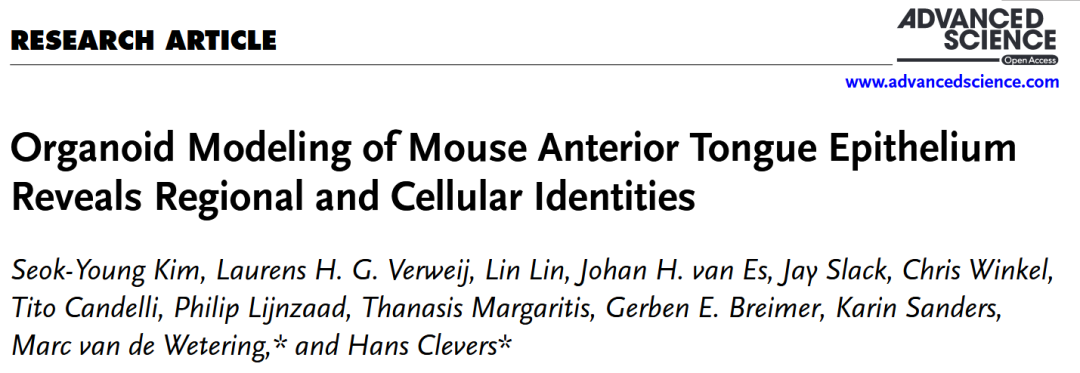
舌作为关键的感觉运动器官,在吞咽、味觉和食物质地感知中发挥核心作用。小鼠舌背部分布着多种上皮细胞,包括基底细胞、Lgr5+/Lgr6+干细胞、味蕾细胞、唾液腺细胞、角质形成细胞和默克尔细胞。这些细胞具有明显的区域分布特征:Lgr5+细胞仅存在于舌后部,而Lgr6+细胞同时分布于舌前部和后部。舌后部的轮廓乳头、叶状乳头与舌前部的菌状乳头在胚胎起源上存在差异,前者源于内胚层,后者源于外胚层。虽然既往研究揭示了舌部的复杂性,但舌前/后部上皮的转录组差异及其区域特异性决定机制尚不明确。类器官作为三维干细胞培养体系,能高度模拟原生组织特征。目前已有研究成功培育出包含多种细胞类型的舌后部类器官,但能够长期传代的舌前部类器官仍属空白。本研究首次建立了小鼠舌前部上皮类器官的培养体系,通过优化培养基组合并结合单细胞转录组分析,深入揭示了舌前部上皮的细胞异质性及其转录调控机制。
Part.02
研究思路
本研究首先致力于解决舌前部上皮体外模型缺失的关键问题,建立了能够长期传代的小鼠舌背前部类器官(ATEM),并证实其保留了舌前部特异性干细胞群(Lgr6+、Sox2+)及转录组特征。利用单细胞转录组测序技术,系统比较了类器官与原生组织,不仅明确了舌前/后部上皮具有截然不同的基因表达谱和基因调控网络,还发现舌后部特征性转录因子在舌前部角质形成细胞分化中意外地被招募利用。通过细胞通讯分析揭示了类器官能模拟舌前部上皮细胞间的核心信号对话,并在分化模型中成功诱导出Krt8+(具默克尔细胞特征)与Krt23+/Sbsn+角质形成细胞等多元细胞类型。通过构建完整的“模型建立-表征验证-机制探索-功能分化”论证链条,阐明了舌背侧上皮区域特异性是由差异化的转录因子网络所主导,并为深入研究舌部生物学提供了强有力的体外工具。
Part.03
研究结果
1. 小鼠舌前部类器官的构建
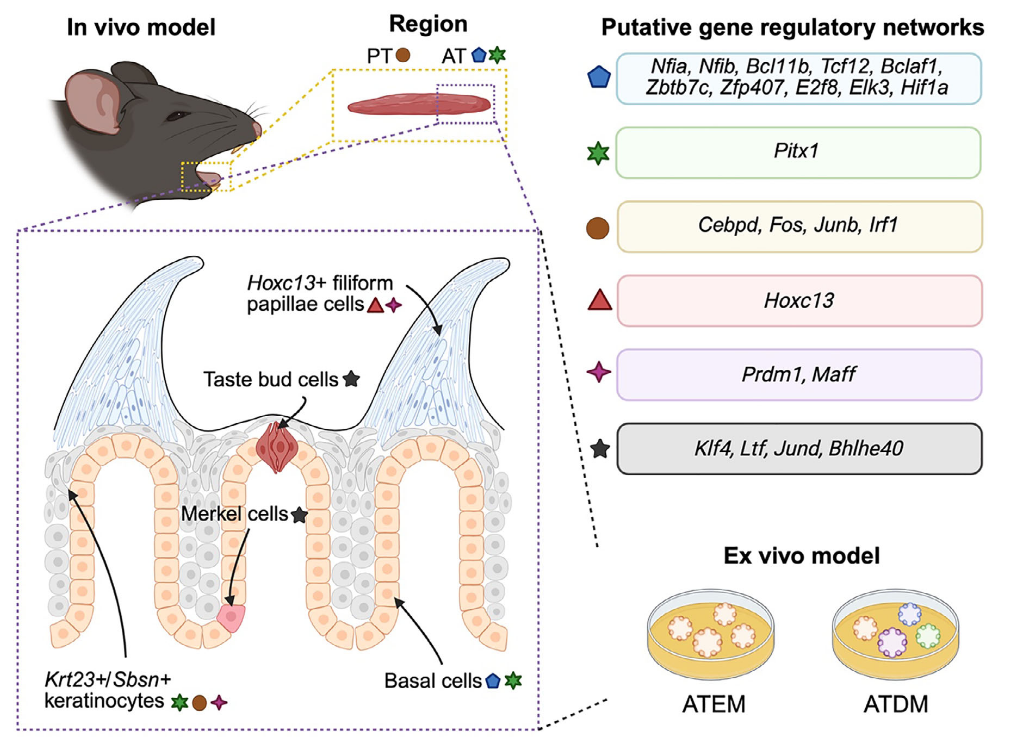
本研究建立了小鼠舌前部组织的类器官培养体系(图1A)。具体流程如下:取小鼠舌尖约2 mm组织以避免舌后部污染,将组织剪碎后包埋于基质胶中,并在含有Wnt、R-spondin 1、Noggin、EGF、A83-01(TGFBR抑制剂)及SAG(Shh通路激动剂)的扩增培养基中培养。相较于既往培养基,新配方中添加了A83-01(可促进多种类器官长期生长)和SAG(对乳头结构稳态至关重要)。由此获得的扩增培养基中的舌前部类器官(ATEM)可稳定传代超过15代,且SAG与A83-01是长期传代的关键要素(图1B)。
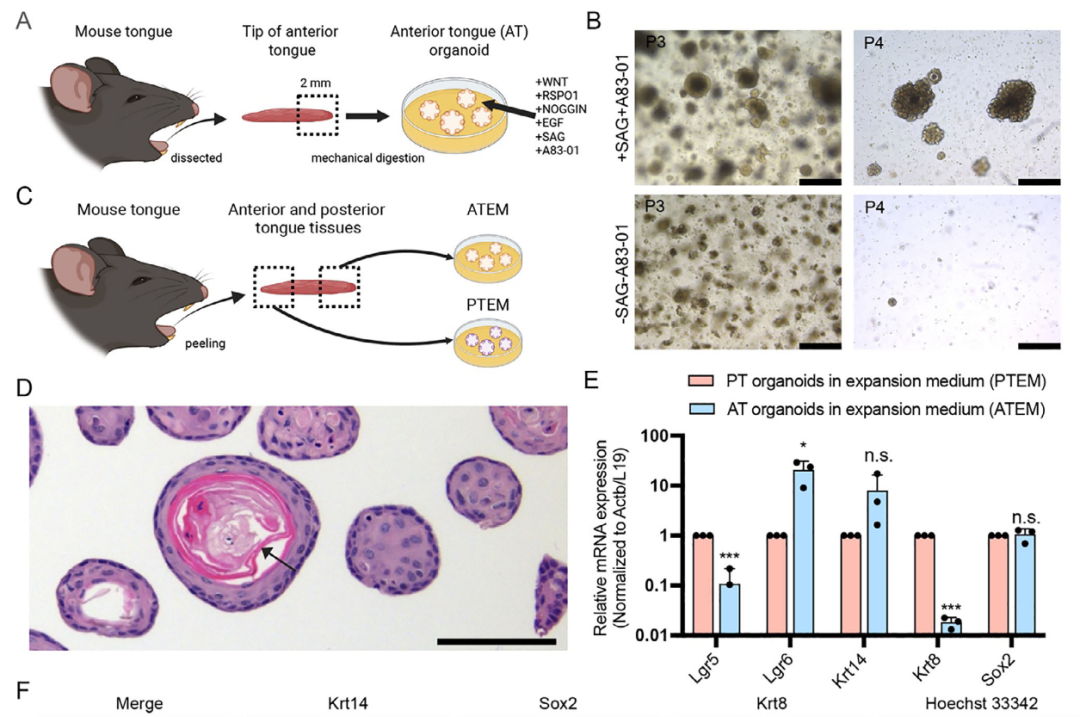
图1
为验证ATEM是否呈现舌部不同细胞群的特征,同步培养了既往报道过的舌后部类器官(PTEM)作为对照(图1C)。组织学分析显示,ATEM由含角质层结构的类器官组成(图1D、图S1A,B)。与ATEM相比,PTEM则呈现伪腺体样结构(图S1C)。
图S1
分子特征分析表明:ATEM中Lgr6的mRNA表达显著高于舌后部类器官,而Lgr5表达较低(图1E);基底细胞标志物Krt14与味觉干/祖细胞标志物Sox2的表达水平在两者间无显著差异;味蕾细胞/唾液腺细胞/默克尔细胞标志物Krt8在ATEM中表达显著较低。免疫荧光染色进一步证实ATEM中Krt14与Sox2强阳性,而Krt8几乎不表达(图1F)。以上结果说明,舌前部类器官具备长期传代能力,且保留了区域特异性的干/祖细胞特征。
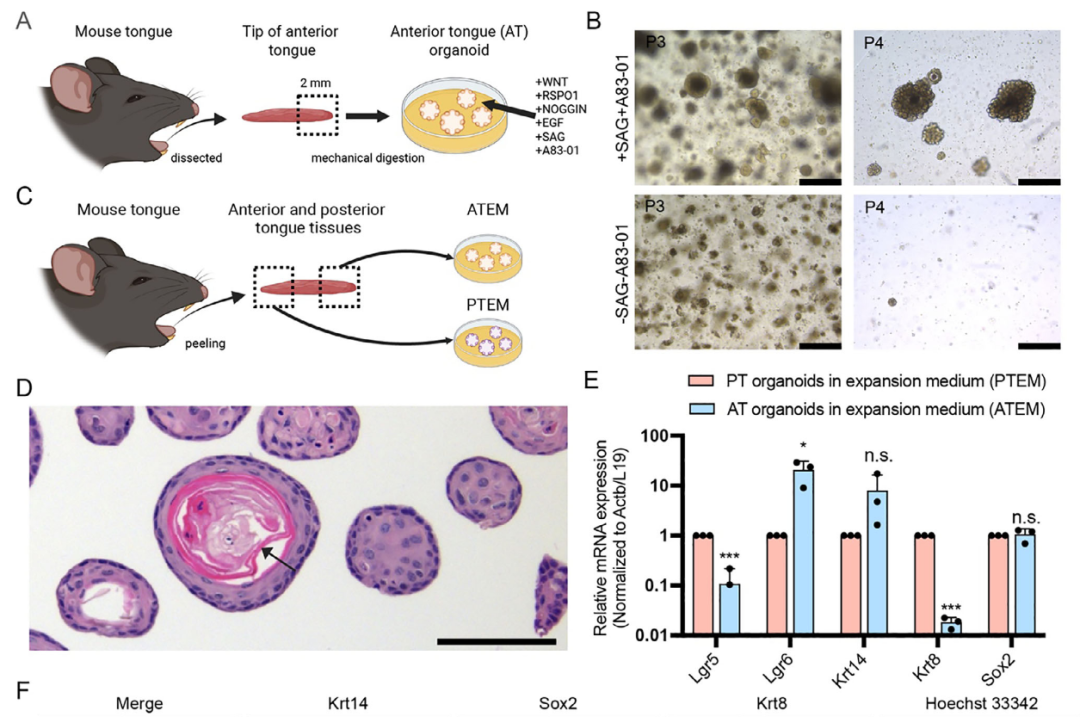
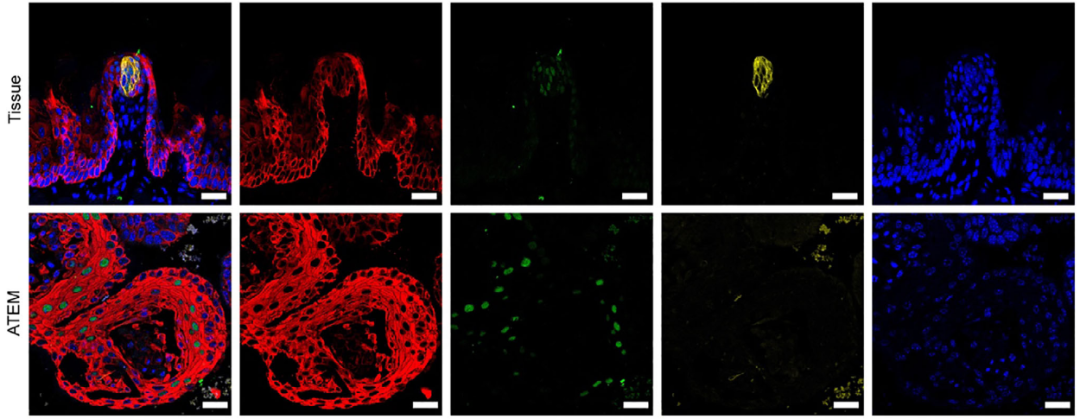
图1
通过10X单细胞mRNA测序进一步分析了ATEM与扩增培养基中的PTEM及组织(舌前部与后部)的细胞与分子异质性。首先通过小鼠组织单细胞测序构建参考数据集(图2A),经质控获得29,608个细胞,其中28,125个上皮细胞用于后续分析(图2B)。根据已知标志基因表达及细胞周期评分识别出循环基底细胞、基底细胞、Lgr6+/Lgr5-细胞、Lgr6+/Lgr5+细胞、Sox9+细胞、角质形成细胞、味蕾细胞及小唾液腺细胞等群体(图2C)。
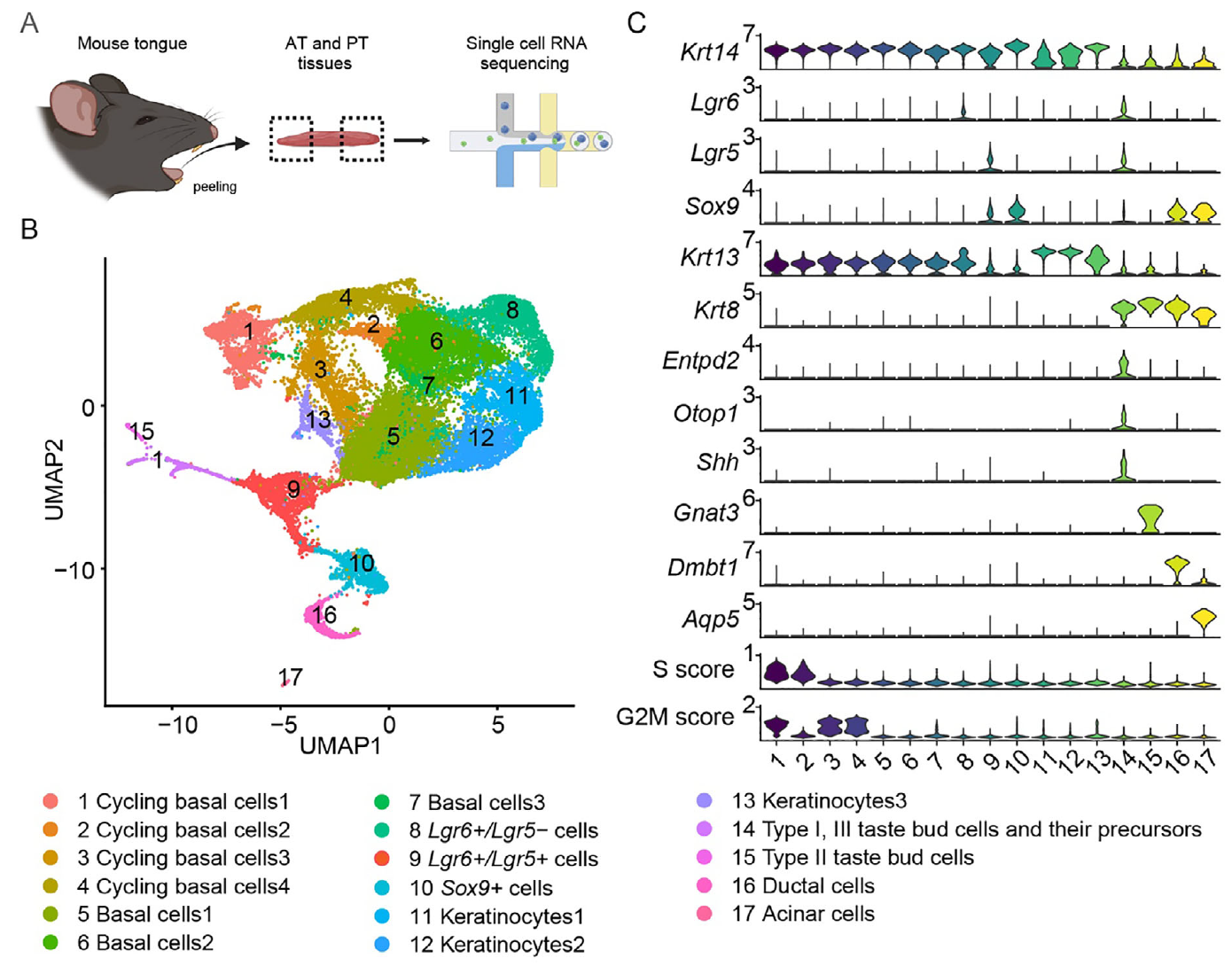
图2
UMAP分析显示多种细胞类型具有显著区域分布特征:基底细胞与角质形成细胞虽保留典型标志物表达,却按组织来源形成独立聚类;Lgr6+/Lgr5+与Lgr6+/Lgr5-细胞分别富集于舌后部与舌前部(图2D)。通过对比两组差异表达基因,研究者们定义了包含85个基因的“舌前部特征谱”与45个基因的“舌后部特征谱”(图2E)。
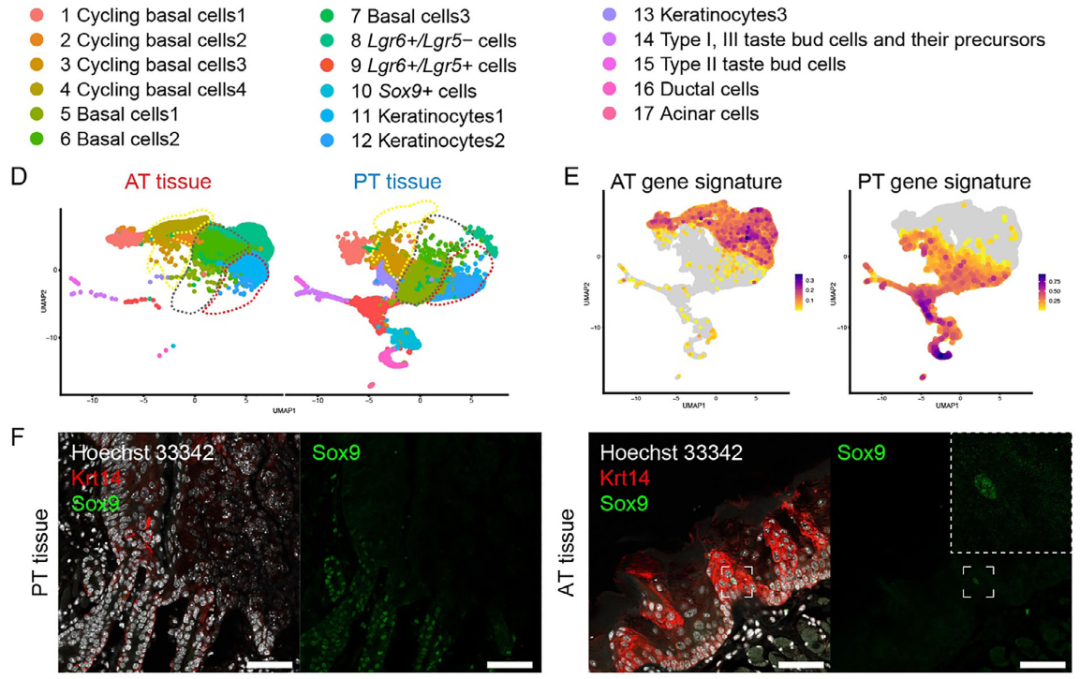
图2
为验证ATEM是否保留舌前部基因特征,研究者进一步对舌类器官进行单细胞测序(图3A)。质控后获得1214个细胞,鉴定出Hoxc13+丝状乳头祖细胞、基底细胞、Lgr6+细胞、Sox9+细胞、I型味蕾细胞及腺泡细胞等(图3B-C)。ATEM主要由基底细胞与Lgr6+细胞构成,而PTEM则包含更多干/祖细胞与Krt8+谱系细胞(图3C)。
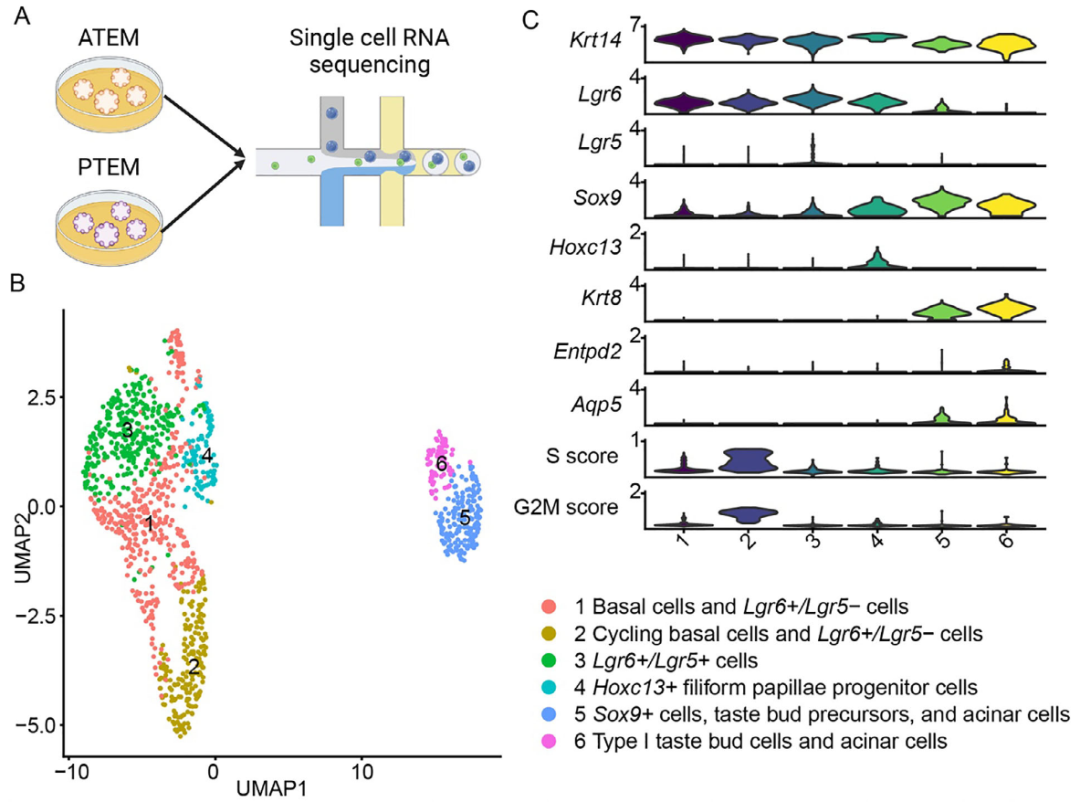 图3
图3
UMAP聚类显示类器官与其来源组织高度对应(图3D),且舌前部特征基因在ATEM中显著富集,舌后部特征基因在PTEM中优势表达(图3E-F)。这些结果证明,ATEM所含的上皮干/祖细胞能够稳定保留舌前部特异性基因特征。
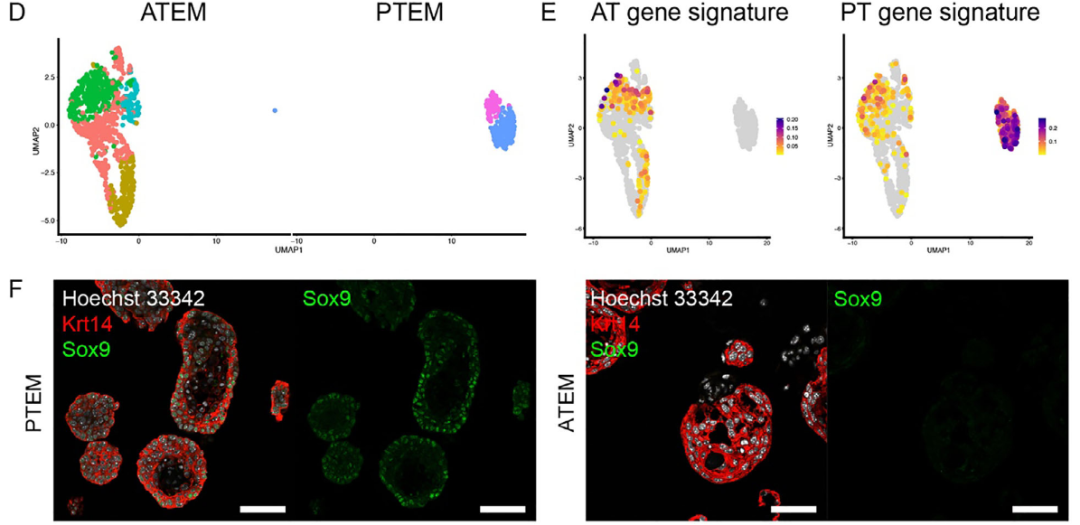
图3
3. 差异化的基因调控网络决定区域与细胞身份
为探究舌背侧上皮区域特性与细胞身份的调控机制,研究者们通过SCENIC分析推断了转录因子调控网络,并采用调控子特异性评分评估其活性。对舌组织及类器官的单细胞测序数据分析显示,基于转录因子调控子活性,舌前部与舌后部富集的UMAP聚类明显分离,表明两类组织具有不同的基因调控网络(图4A)。在舌前部组织中,E2f8、Bcl11b及Pitx1等转录因子(统称为“舌前部转录因子”)发挥关键作用(图4B)。RSS分析表明,这些因子在循环基底细胞、基底细胞及角质形成细胞中活性尤为突出(图4C)。进一步分析发现,这些细胞类型的标志基因中有大量与舌前部转录因子的调控子重叠(图4D),表明这些因子共同决定了舌前部的区域特性及相关细胞类型的分化。在舌后部组织中,Cebpd及AP-1家族基因(Fos、Fosb、Junb)等舌后部转录因子占据主导(图4E)。
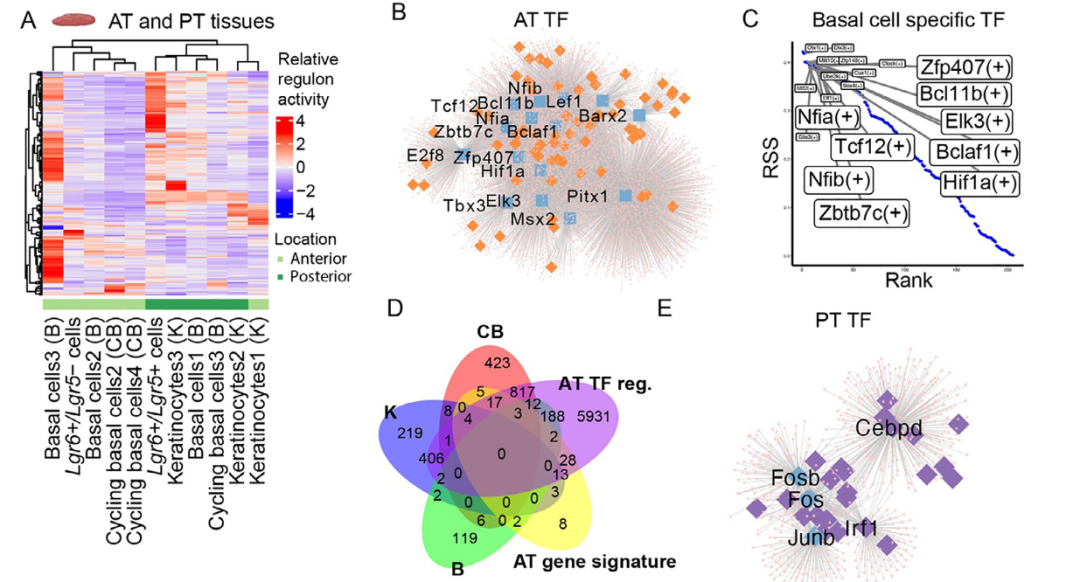
图4
重要的是,类器官模型部分重现了组织中观察到的区域性与细胞类型特异性调控网络。ATEM与PTEM的UMAP聚类仍按区域来源分离,且Hoxc13+丝状乳头祖细胞等特定群体在类器官中仍由对应转录因子驱动(图4G)。这些结果表明,特定转录因子及其调控网络共同塑造了舌背侧上皮的区域特性与细胞多样性。
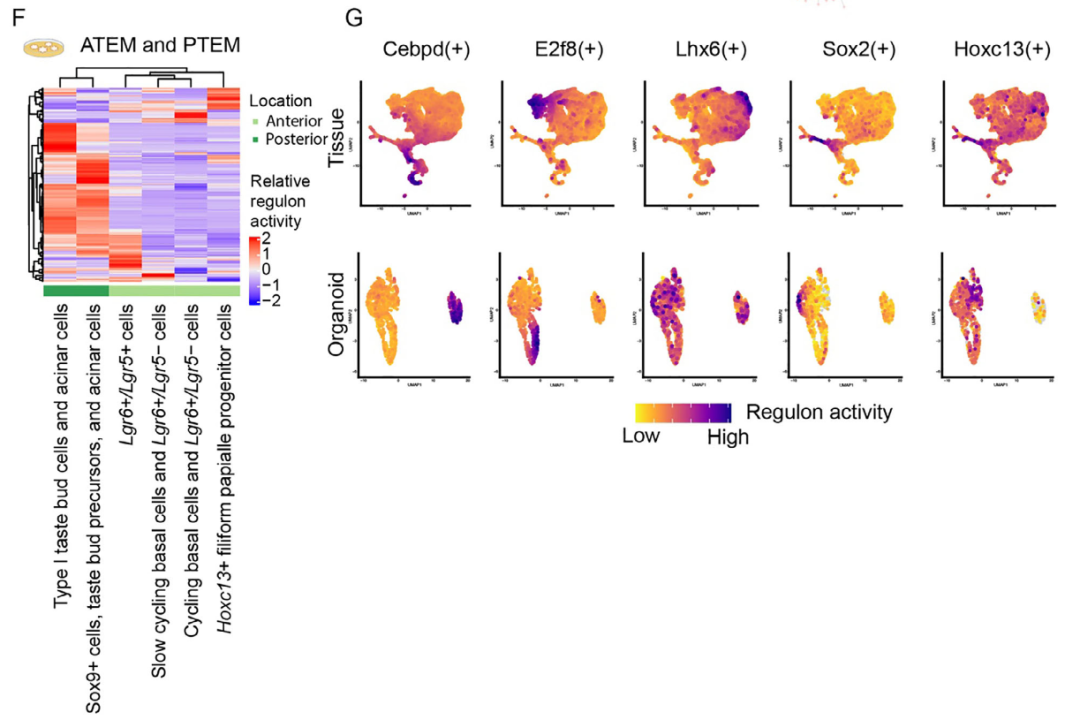
图4
为解析舌前部上皮的细胞间通讯网络,研究者们对舌前部组织及ATEM类器官进行了CellChat分析。在组织中,上皮细胞之间及上皮与基质细胞(成纤维细胞、内皮细胞)之间存在广泛信号交互,其中Wnt、Notch、BMP和EGF等通路主要通过自分泌/旁分泌形式在上皮细胞中活跃(图5A-B)。在ATEM中,由于培养基添加SAG激活Shh通路,Lgr6+/Lgr5+细胞中可观察到Sox2调控子活性及Gli1、Ptch1高表达。为进一步验证关键信号通路对细胞增殖的调控作用,在ATEM中进行了生长因子撤除/添加实验。结果显示,单独撤除EGF不影响类器官活力,但同时加入泛ERBB抑制剂阿法替尼则显著抑制细胞生长,表明ATEM通过自身产生配体激活EGF通路(图5C-D)。这些结果共同证明,ATEM类器官模型能够有效模拟舌前部上皮细胞间的关键通讯机制。
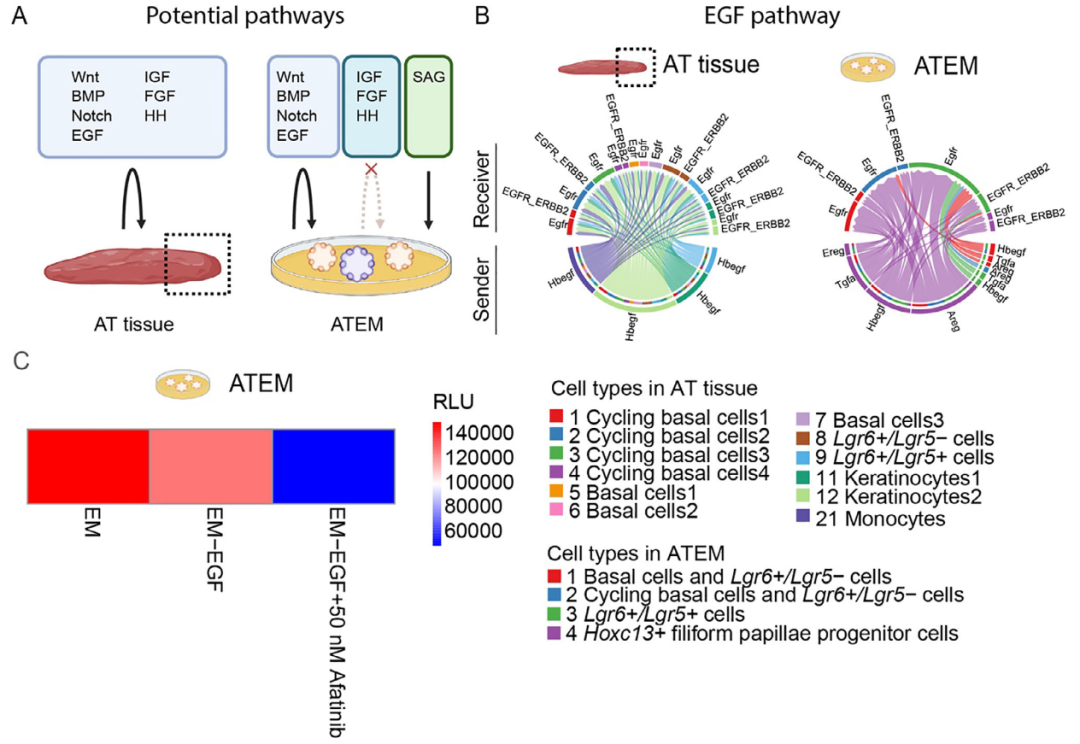
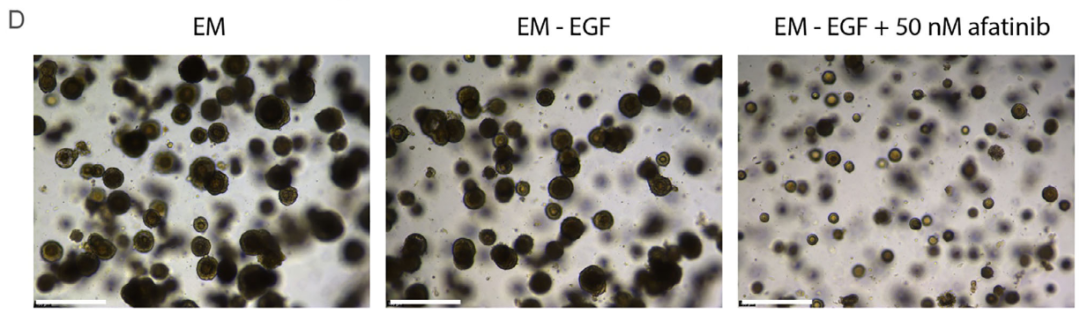
图5
为探究ATEM中干/祖细胞能否向特化上皮细胞分化,将类器官转入分化培养基(ATDM)培养两周。该培养基在撤除R-spondin 1、EGF、SAG及A83-01的基础上,添加了γ-分泌酶抑制剂DAPT与维生素A(图6A)。分化后,ATDM中Krt4、Krt13(角质形成细胞通用标志物)及Krt8表达显著上调(图6B)。单细胞测序分析进一步揭示ATDM包含Krt8+细胞、Krt23+/Sbsn+角质形成细胞、Sox9+细胞、循环基底细胞及基底细胞等多种群体(图6C-E)。
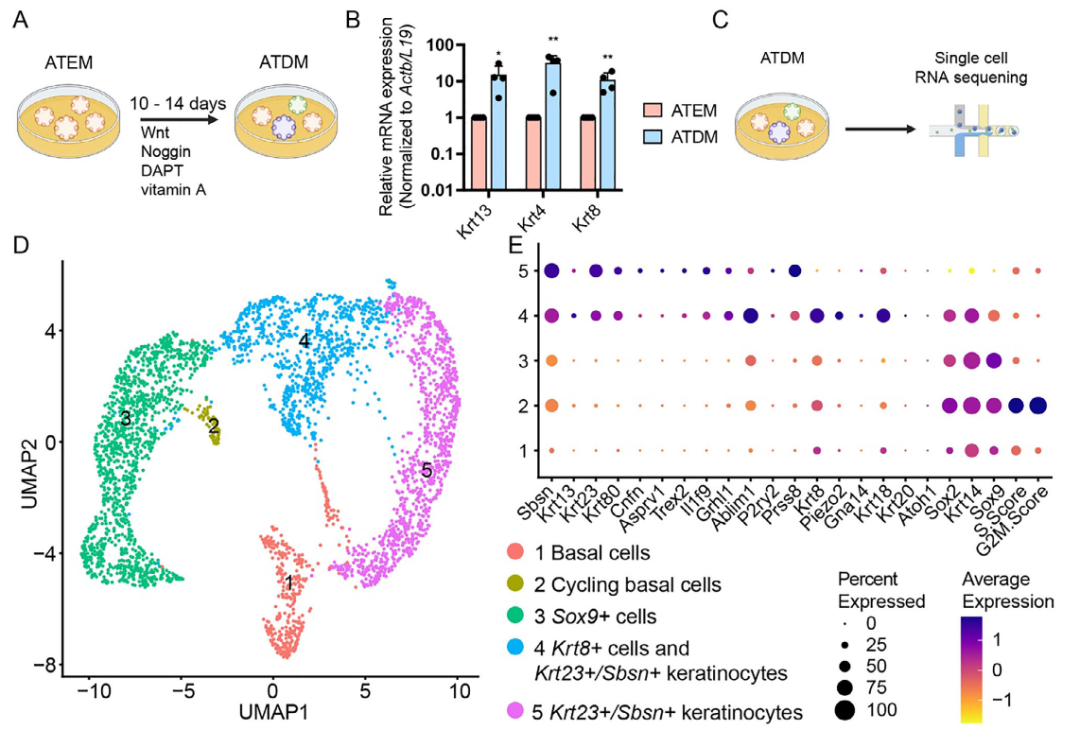
图6
值得注意的是,Krt8+细胞高表达机械敏感离子通道Piezo2(图6F-H),该分子是介导触觉、痛觉与本体感觉的关键因子。这些细胞同时表达Krt18与Sox2,但不表达Krt20与Atoh1,符合口腔默克尔细胞特征。
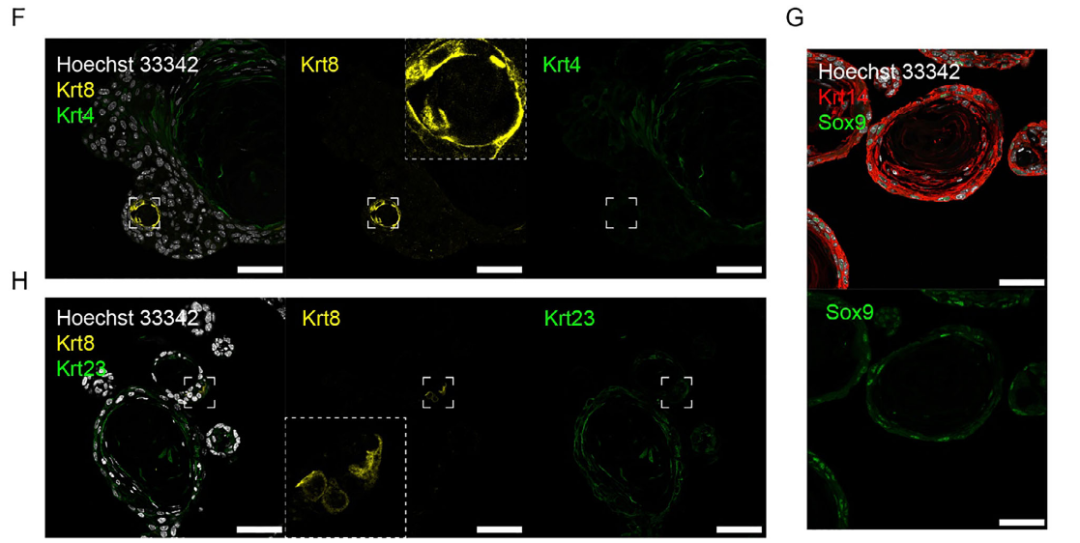
图6
6. 基因调控网络分析揭示Krt8+与Krt23+/Sbsn+细胞分化的关键转录因子
通过整合ATEM与ATDM的单细胞转录组数据(图7A),发现分化过程中循环基底细胞、基底细胞及Lgr6+/Lgr5-细胞比例显著下降,而Krt8+细胞与Krt23+/Sbsn+角质形成细胞明显增加(图7B-C)。SCENIC分析显示,Klf4等转录因子在Krt8+细胞分化中起关键作用(图7C-E),而Klf7、Rreb1、Nfib等因子可能协同调控Piezo2+表达,提示Krt8+细胞需额外转录程序以获得类默克尔细胞命运。在Krt23+/Sbsn+角质形成细胞中,Prdm1、Maff及Pitx1等转录因子高度活跃(图7C,D,F)。值得注意的是,原本在舌后部组织中特异性表达的Cebpd与Irf1,分别于Sox9+细胞与Krt23+/Sbsn+细胞中呈现高活性(图7C,H),表明舌后部相关转录因子在舌前部角质形成细胞分化中可能发挥新的作用。比较分析显示,Cebpd、Irf1、Fos及Junb等舌后部特征转录因子的调控子活性在ATDM中显著升高(图7G)。
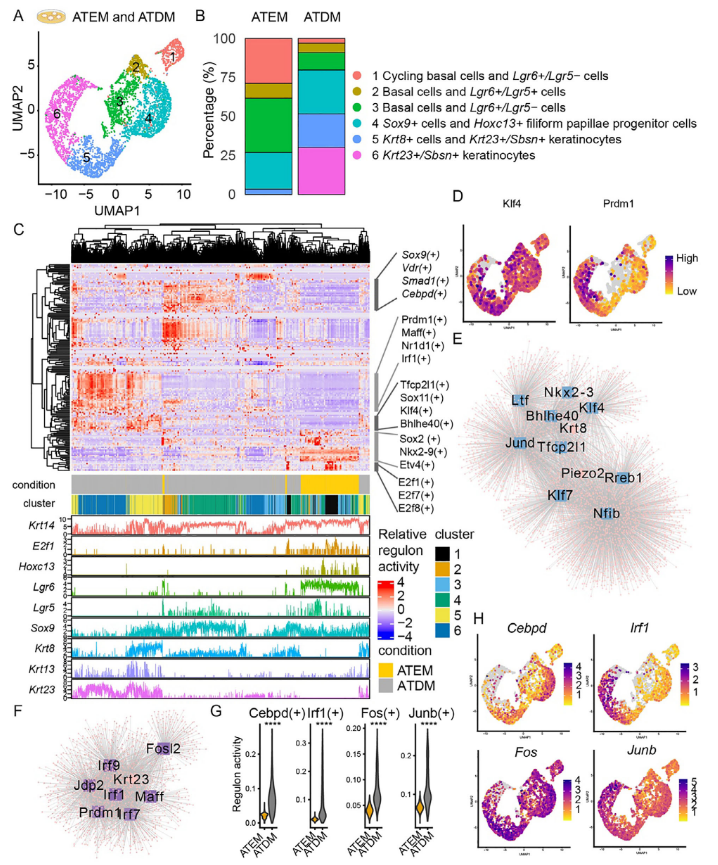
图7
综上所述,Krt8+细胞与Krt23+/Sbsn+细胞分别遵循不同的转录调控程序实现分化,其中Krt23+/Sbsn+角质形成细胞的分化受到舌后部相关转录因子的显著影响。
小结
本研究阐明,舌前部上皮主要由基底细胞/角质形成细胞谱系相关转录因子驱动,而舌后部上皮则受细胞迁移与增殖相关因子主导,两类区域在上皮分化过程中存在明显的转录调控差异。
参考文献:
Kim SY, Verweij LHG, Lin L, et al. Organoid Modeling of Mouse Anterior Tongue Epithelium Reveals Regional and Cellular Identities. Adv Sci (Weinh). Published online September 29, 2025. doi:10.1002/advs.202506738
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


